
凍らせてナノまで迫る〜クライオ電子顕微鏡の構造解析が切り拓く新しい未来
VOL.65
INGEM 東北大学未来型医療創成センター
生命の最も基本的な仕組みを理解するために、科学者たちは長年にわたって分子レベルでの観察技術の向上に取り組んできた。特に生物の体内にある細胞の中の小さな分子の形と動きを自然な状態に近い形で観察することが重要だ。その中で特に注目を集めているのが、クライオ電子顕微鏡という最新鋭の技術。従来の観察手法では不可能だった生きた状態での分子の詳細な構造解析を実現し、創薬研究や基礎生物学研究に革命的な変化をもたらしている。2017年にはノーベル化学賞を受賞するほどの画期的な成果として認められている。
東北大学未来型医療創成センター(INGEM)に国立研究開発法人日本医療研究開発機構(AMED) の生命科学・創薬研究支援事業(BINDS)により導入された最先端のクライオ専用の電子顕微鏡を用いて研究を進めるINGEM・東北大学大学院生命科学研究科の横山武司助教とINGEM生体高分子構造解析グループの齋藤律水学術研究員にお聞きした。
クライオ電子顕微鏡はどのように分子レベルの生体の動きに迫るのか?
電子線を使って物体を観察する電子顕微鏡。極めて小さなものを見ることができる優れた技術だが装置内部を真空状態に保つ必要がある。空気が存在すると、酸素分子などの影響で照射した電子線が曲がってしまい観察ができなくなるためだ。しかし、生物由来のサンプルを真空環境に置くと、水分が蒸発してしまい、タンパク質や細胞は本来の構造を保てなくなってしまうという問題が出てくる。
「生物学で観察したい、タンパク質などの小さな分子を観察するためには電子顕微鏡の中に入れる必要がありますが、同時に真空環境では分子が壊れてしまうという、ジレンマが存在していました。それを解決し、生命の微細な世界を見せてくれるのがクライオ電子顕微鏡です」と横山助教は話す。
クライオ電子顕微鏡法は、生命にとって不可欠な水の中にタンパク質が溶けた状態の溶液を極めて短時間で「急速凍結」させて観察するという点が特徴的な手法だ(「クライオ」とは、「低温」という意味)。この手法を用いると、凍らせることで生物が生きていた時に非常に近い状態で薄い氷の膜の中に閉じ込めるができ、氷に守られたタンパク質は真空環境でも蒸発することなく、本来の構造を維持しながら観察することが可能となる。さらに、高エネルギーの電子線は通常であれば分子を破壊してしまうが、この手法を使えば電子線による損傷も低温状態では大幅に軽減できるというメリットがある。

東北大学未来型医療創成センター・東北大学大学院生命科学研究科の横山武司助教

クライオ透過型電子顕微鏡 CRYO ARM™ 300 II(日本電子株式会社製)
加速電圧 300 kV、冷陰極電界放出型電子銃 直接検出型カメラK3™ (GATAN社製)
極低温での精密作業を高度な技術的挑戦で実現
「細胞を対象とした研究では、さらに複雑な前処理が必要になります。細胞は電子線が透過するには厚すぎるため、クライオFIB-SEM(集束イオンビーム走査型電子顕微鏡)という装置を用いて、100ナノメートル程度の極薄切片を作製する必要があります」と話す齋藤学術研究員。
クライオFIB-SEMは凍結した細胞をイオンビームで薄く削り、細胞内の様子をクライオ電子顕微鏡で観察できるようにする装置だ。「作成する薄膜の厚さは100nm前後で、コピー用紙の大体1/1000くらいの厚さです。クライオ電子顕微鏡では基本的にタンパク質を細胞から取り出して観察しますが、クライオFIB-SEMを活用すると、細胞の中そのままの状態を観察できます。観察対象はミトコンドリアなどの細胞内小器官から酵素などのタンパク質までと様々で、従来のクライオ電子顕微鏡法と組み合わせてより多くの情報を得ることができます」
この作業は、例えるなら氷上での精密な彫刻作業だという。熟練した技術と集中力が要求され、最終的なデータにたどり着くのは経験を積んでも4割程度と、多くの試行錯誤が必要である。「細胞を薄膜に加工していざクライオ電子顕微鏡で観察してみると、ただモヤモヤした画像だけで何の情報も得られないことがあります。多くの場合、細胞は大部分を核が占めるので、やみくもに薄膜を作ると核の中だけを観察することになってしまいます。見たいものがありそうな場所を狙って加工するのが難しく、初めてクライオ電子顕微鏡でミトコンドリアを捉えたときは達成感がありました」と作業の大変さを語る。

東北大学未来型医療創成センター 生体高分子構造解析グループの齋藤律水学術研究員

クライオ走査型電子顕微鏡 CRYO-FIB-SEM:JIB-4700F(日本電子株式会社製)
クライオ蛍光顕微鏡システム(クライオチャンバー:Linkam Scientific Instruments社製、蛍光顕微鏡:ニコンソリューションズ社製)
さらに、この作業により作製された生体試料は常にマイナス190度程度の極低温に保たれており、すべての作業を液体窒素中で行う必要がある。
横山助教は話す。「生体試料は常に低温状態に保つ必要があるため、液体窒素の中でピンセットを用いた細かな作業をするテクニックが求められます。ピンセットを液体窒素温度に十分冷やしておかないと、貴重なタンパク質を含む氷が溶けてしまうこともあります。そうなると、一から実験をやり直す必要があります」
まさにテレビ番組のチャレンジアトラクションSASUKEのような過酷な作業。一つでも手順を誤ると、貴重なサンプルが瞬時に破壊されてしまうという。特に困難なのは、凍結したサンプルを電子顕微鏡に移送する作業で、ピンセットなどの器具も事前に液体窒素で冷却し、室温との接触を完全に避けながら慎重に操作しなければならない。大気中の水分も大敵で、湿度管理された環境での作業が不可欠である。

作製された生体試料は常にマイナス190度程度の極低温に保つ必要がある。極度の集中力で生体試料をクライオ電子顕微鏡まで運ばなければならない。

静止画から「動き」を再構成するための画像処理技術
クライオ電子顕微鏡で得られるのは、凍結された瞬間の静止画像である。しかし、研究者たちが本当に知りたいのは、分子が「どのように動き、機能しているか」という動的な情報である。この一見矛盾する要求を解決するのが、高度な画像処理技術とスーパーコンピューターの活用である。
「分子は常に動いており、様々な形状を取りながら機能を発揮しています。急速凍結の過程で、多数の分子がそれぞれ異なる動きの瞬間で固定されています。これらの多様な形状を大量に撮影し、コンピューター上で分類・解析することで、分子の動きのパターンを再構築することができるわけです」と話す横山助教。
つまり、パラパラ漫画の原理に似ており、静止画の連続から動きを理解する技術。さらに、スーパーコンピューターによる画像処理では、二次元の電子顕微鏡画像から三次元の立体構造を復元する複雑な計算が行われる。この処理により、原子レベルでの詳細な構造情報が得られ、薬剤がどの部位に結合するかといった創薬に直結する情報も明らかになる。結晶化という極めて困難な前処理が必要だったX線結晶構造解析などの従来の方法と比較して、クライオ電子顕微鏡は日常的に利用できる技術として研究現場に革命をもたらしている。

クライオ電子顕微鏡を操作する様子。多くの調整を乗り越えて、生物の微細な世界が可視化される。
どのような領域で活用されているか?薬剤耐性問題への挑戦
では、最先端のクライオ電子顕微鏡を活用して、どのような分野で、どのような成果が出ているのだろうか。
「さまざまな生体分子の構造解析をもとに創薬分野で研究を行っています。現代医学が直面する最も深刻な課題の一つが、AMR(アンチマイクロバイアルレジスタンス)と呼ばれる薬剤耐性問題です。細菌が抗生物質に対する耐性を獲得し、従来の治療法が効かなくなる現象です。何の対策も講じなければ、2050年までに薬剤耐性菌による死者数ががんによる死者数を上回ると予測されており、人類全体で取り組むべき緊急課題となっています」と話す横山助教。
この問題解決の鍵となるのが、細菌にあるリボソームという遺伝情報を読み取ってタンパク質を合成する細胞内の分子装置だ。多くの抗生物質は、このリボソームの機能を阻害することで細菌を死滅させるが、抗生物質に対する耐性を獲得した薬剤耐性菌は、従来の抗生物質に対して様々な防御機構を発達させている。例えばクラリスロマイシンやアジスロマイシンといったマクロライド系抗生物質に対しては、結合部位に構造変化を起こして薬剤の結合を阻害してしまう。
「この問題を解決するため、研究チームは既存の抗生物質に様々な化学修飾を加え、耐性機構を回避できる新しい化合物の開発に取り組んでいます。特に結核菌を対象とした研究では、従来の結合部位とは異なる場所でリボソームに結合する新規抗生物質の開発に成功しています」
クライオ電子顕微鏡による詳細な構造解析により、この新しい抗生物質が薬剤耐性機構を回避してリボソームの機能を阻害する様子が確認されており、2025年に論文発表を行った。
「学生たちの研究の一環として大規模なスクリーニング研究にも取り組んでいます。数百種類の化合物ライブラリーから、リボソームの機能を阻害する新規化合物を探索し、有望な候補についてクライオ電子顕微鏡による詳細な作用機序解析を行います。このアプローチにより、従来とは全く異なる角度からの抗生物質開発が可能になっています」
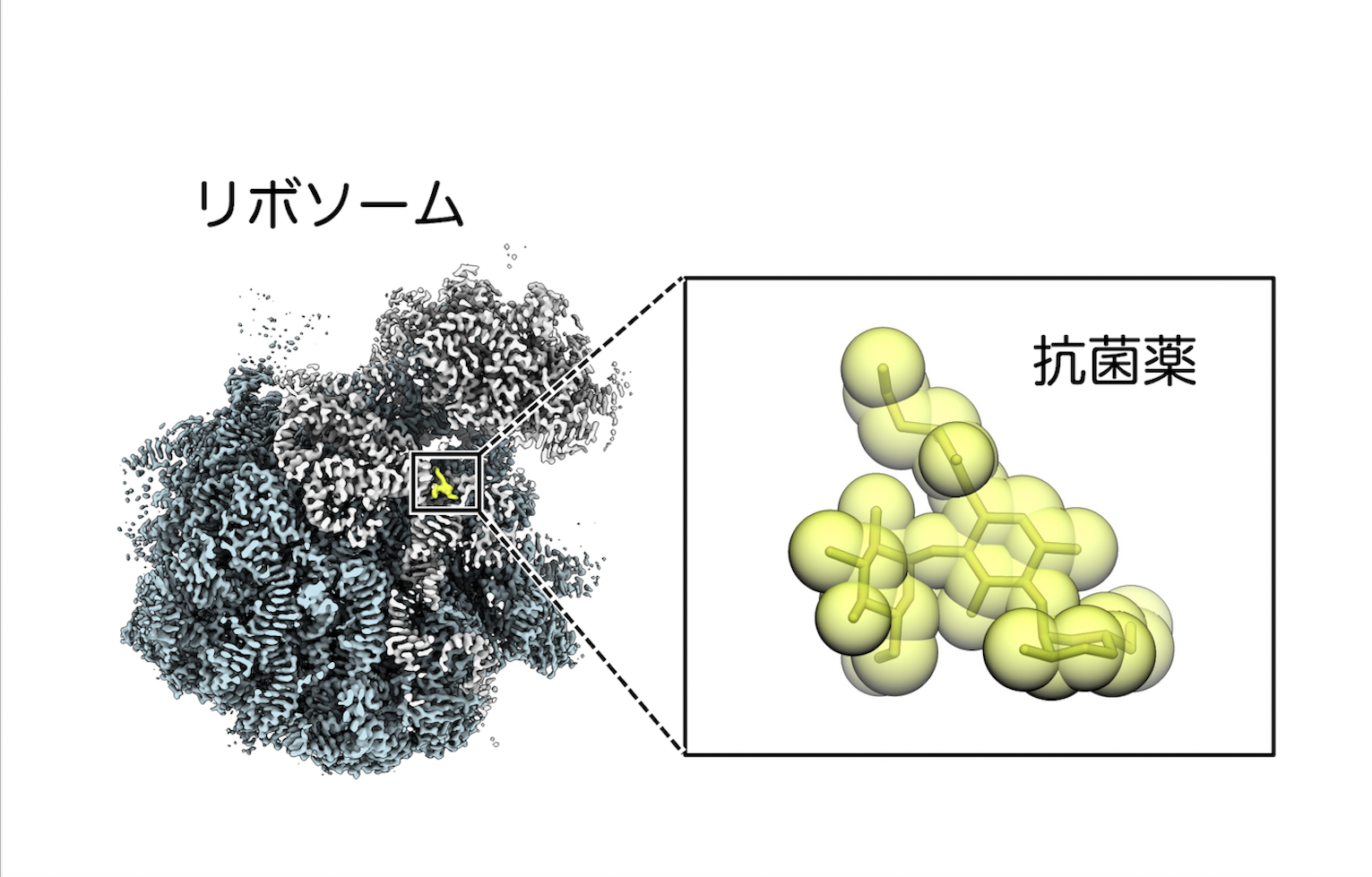
リボソームを舞台とした、抗菌薬と薬剤耐性機構の攻防を分子レベルで観察しながら、新たな創薬に結びつけている。

クライオ電子顕微鏡と生体試料づくりの試行錯誤によりナノレベルでの動態を追究し、地道にしかしダイナミックに創薬の研究を進めている。
東北から全国へ、地域研究拠点としての役割を担う
「私たちの電子顕微鏡施設の使命の一つは、AMED BINDSプロジェクトを初めとして、東北地区を中心とした全国の大学、研究機関、民間企業にクライオ電子顕微鏡のプラットフォームを提供することにあります」と話す横山助教。
東北地区初のクライオ電子顕微鏡施設として、この装置は地域の研究インフラとして重要な役割を果たしており、WEBサイトでは広く利用申込も受け付けている。従来、東北地区の研究者がタンパク質の構造解析を行う場合、東京や大阪の施設まで出向く必要があったが、地元での研究が可能になったことで、研究効率は大幅に向上した。この施設は、AMEDのプロジェクトの一環として運営されており、全国の研究機関との共同研究も活発に行われている。山形大学をはじめとする東北地区の大学はもちろん、東京大学、京都大学など全国各地から研究者が訪れ、共同で構造解析研究を進めている。
「いま多くの共同研究者、利用者が全国から訪れ、電子顕微鏡の前に座り、新しい発見を共有しながら研究を進めています。この施設はまさに神社のような存在。研究者たちがここに集まり、それぞれの研究対象である分子の構造を観察し、新たな発見を持ち帰る。長年研究してきたタンパク質の実際の姿を初めて目にする研究者の感動は、この施設が提供する最も価値ある体験の一つではないでしょうか」
クライオ電子顕微鏡はいま創薬研究全般に大きな影響を与えている。従来は困難だった膜タンパク質や大型タンパク質複合体の構造解析が日常的に行えるようになり、新薬開発のスピードと精度が大幅に向上している。極低温の世界で繰り広げられる分子レベルの精密な観察技術は、生命の謎を解き明かし、人類の健康と福祉の向上に直結する重要な研究基盤として、今後ますますその価値を高めていくことが期待される。

INGEM 東北大学未来型医療創成センター
宮城県仙台市青葉区星陵町2-1 東北大学 東北メディカル・メガバンク棟4階
HP:https://www.ingem.oas.tohoku.ac.jp/

































